Peristiwa Terlepasnya Elektron Terluar Akibat Atom Menyerap Energi
 Peristiwa Terlepasnya Elektron Terluar Akibat Atom Menyerap Energi
Peristiwa Terlepasnya Elektron Terluar Akibat Atom Menyerap Energi Tahukah kamu peristiwa terlepasnya elektron terluar akibat atom menyerap energi?
Peristiwa terlepasnya elektron terluar akibat atom menyerap energi biasa dikenal sebagai eksitasi.
Melansir laman resmi Universitas Pendidikan Indonesia (UPI), eksitasi terjadi karena absorbsi gelombang elektromagnetik.
Absobsi thermal atau reaksi kimia seperti reaksi bioluciferase.
Proses absorbsi untuk sederet peristiwa terjadi dalarn waktu sekitar 10-18 detik atau kurang.
Pada selang waktu tersebut, atom tidak mengalami gerakan.
Kondisi ini menjadi dasar prinsip Frank-Condon, yakni molekul urniun memasuki keadaan tereksitasi setelah adanya penyerapan elektronik.
Biasanya molekul organik memiliki tingkat dasar tunggal (singlet), kecuali radikal-radikal bebas yang dinyatakan dengan So, keadaan tunggal tereksitasi yang dinyatakan sebagai SI, Sz.
Hal itu mengacu berdasarkan tingkat kenaikan energi dan keadaan triganda (triplet) yang dinyatakan dengan TI, Tz dan seterusnya.
Molekul organik yang telah menyerap energi cenderung menempati kondisi tereksitasi singlet daripada keadaan triplet karena peralihan So + TI.
Hal itu menyangkut perubahan kelipatgandaan spin yang terlarang keras.
Proses eksitasi terjadi membawa molekul yang berada pada keadaan dasar dengan tingkat vibrasi terendah ke keadaan singlet tereksitasi.
Dalam proses eksitasi, biasanya juga terjadi persilangan antar sistem dari singlet tereksitasi terendah ke triplet terendah.
Proses menjadi yang penting karena memiliki waktu hidup yang panjang.
Meski demikian, kehilangan energi karena perpindahan triplet terendah ke keadaan dasar bisa saja terjadi karena proses radiatif yang disebut fosforesensi.
Penyebab Atom Menyerap Energi
Selain peristiwa terlepasnya elektron terluar akibat atom menyerap energi, sebaiknya kamu juga memahami penyebab atom menyerap energi.
Melansir laman resmi Kementerian Pendidikan dan Kebudayaan, atom menyerap energi karena atom terdiri dari proton sebagai inti dan elektron yang mengitari inti.
Ketika mengelilingi inti, elektron mengelilingi semacam lintasan yang mirip seperti lintasan planet yang mengelilingi matahari.
Dari kondisi itu, elektron setiap lintasan mempunyai energi tertentu.
Elektron ini mampu melompat dari satu lintasan ke lintasan lainnya.
Elektron yang paling luar biasanya yang paling rentan karena berada pada titik terjauh dari inti.
Jika elektron ini diberikan energi atau cahaya, maka dia akan mampu keluar dari lintasannya pada sistem atom (tereksitasi).
Meski demikian, hal sebaliknya juga terjadi, elektron akan kembali lagi ke lintasan dengan melepas energi.
Baca buku sepuasnya di Gramedia Digital Premium
Energi untuk setiap lintasan atom yang berbeda, untuk itu elektron pada setiap atom akan mampu menyerap dan melepaskan energi dengan panjang gelombang yang spesifik untuk atom.
Selain itu, atom bisa menyerap atau mengeluarkan energi cahaya dengan panjang gelombang tertentu karena setiap elektron yang menyerap cahaya tersebut adalah elektron valensi (atau elektron kulit terluar).
Setiap atom terdapat nilai energi ionisasi yang berbeda bagi setiap atom (atau unsur) yang berbeda.
Dengan kondisi tersebut, jika cahaya diserap, maka cahaya tersebut diserap dengan panjang gelombang yang berbeda.
Hal ini yang menyebabkan terbentuk spektrum penyerapan dimana garis-garis gelap merupakan spektrum yang diserap oleh inti tersebut.
Spektrum emisi (atau spekrum pancaran) menjadi spektrum yang dipancarkan oleh suatu inti dengan panjang gelombang yang tertentu.
Panjang gelombang ini berkaitan dengan tingkat energi inti tersebut.
Kondisi ini sebenarnya dijelaskan melalui mekanika kuantum.
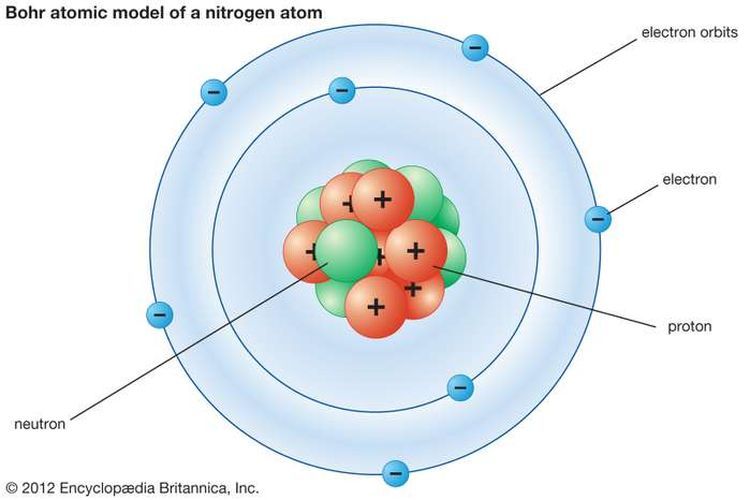
Model Atom Bohr
Terdapat beragam model atom yang dipelajari dan model atom Bohr menjadi salah satu teori yang terkenal.
Model atom ini dicetuskan oleh Niels Bohr, ilmuwan pertama yang mengembangkan teori struktur atom pada 1913.
Melansir Kimia Dasar, berikut sifat dasar atom berdasarkan model atom Bohr:
Atom terdiri dari inti yang bermuatan positif dan dikelilingi oleh elektron yang bermuatan negatif di dalam suatu lintasan.
Elektron bisa berpindah dari satu lintasan ke lintasan yang lain dengan menyerap atau memancarkan energi sehingga energi elektron atom itu tidak akan berkurang.
Apabila berpindah ke lintasan yang lebih tinggi, elektron akan menyerap energi.
Sementara itu, jika berpindah ke lintasan yang lebih rendah, elektron akan memancarkan energi.
Kedudukan elektron-elektron pada tingkat-tingkat energi tertentu-tertentu yang disebut kulit-kulit elektron.
Sifat-sifat berkala dari unsur-unsur bila disusun berdasarkan kenaikan berat atom, terdapat keteraturan yang sistematis dari frekuensi garis spektrum.
Lalu, partikel yang bermuatan listrik yang sedang bergerak dalam lintasan lengkung, diperkirakan memberikan tenaga radiasi ke sekeli.
Ingin mengetahui lebih banyak tentang atom? Kamu bisa membaca Buku Pengayaan Kimia: Atom, Ion, dan Molekul karya Ibnu Shohib.
Buku ini membahas tentang atom, ion, dan molekul untuk menambah pengetahuanmu.
Tertarik untuk membacanya? Segera check out di Gramedia.com!
Selain itu, ada gratis voucher diskon yang bisa kamu gunakan tanpa minimal pembelian. Yuk, beli buku di atas dengan lebih hemat! Langsung klik di sini untuk ambil vouchernya.
 Promo Diskon
Promo DiskonTerkini Lainnya